Selasa, 10 April 2012
Teori Kinetik (atau teori kinetik pada gas) berupaya menjelaskan sifat-sifat makroscopik gas, seperti tekanan, suhu, atau volume, dengan memperhatikan komposisi molekular mereka dan gerakannya. Intinya, teori ini menytakan bahwa tekanan tidaklah
disebabkan oleh denyut-denyut statis di antara molekul-molekul, seperti yang diduga Isaac Newton, melainkan disebabkan oleh tumbukan antarmolekul yang bergerak pada kecepatan yang berbeda-beda. Teori Kinetik dikenal pula sebagai Teori Kinetik-Molekular atau Teori Tumbukan atau Teori Kinetik pada Gas.
Teori Kinetik juga telah diperluas untuk memasukkan tumbukan tidak lenting di dalam materi butiran oleh Jenkins dan kawan-kawan.[rujukan?]
Partikel memberi tumbukan kepada dinding sekali setiap 2l/vx satuan waktu (di mana l adalah panjang wadah). Kendati partikel menumbuk sebuah dinding sekali setiap 1l/vx satuan waktu, hanya perubahan momentum pada dinding yang dianggap, sehingga partikel menghasilkan perubahan momentum pada dinding tertentu sekali setiap 2l/vx satuan waktu.
Besaran kecepatan untuk tiap-tiap partikel mengikuti persamaan ini:
Misalkan ada sejumlah besar partikel yang bergerak cukup acak, gaay pada tiap-tiap dinding akan hampir sama dan kini perhatikanlah gaya pada satu dinding saja, kita punya:
 dapat dituliskan sebagai
dapat dituliskan sebagai 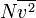 , di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan
, di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan  di mana vrms dalah akar kuadrat rata-rata kecepatan semua partikel.
di mana vrms dalah akar kuadrat rata-rata kecepatan semua partikel.
Jadi, gaya dapat dituliskan sebagai:
Jadi, karena luas bagian yang berseberangan dikali dengan panjang sama dengan volume, kita punya pernyataan berikut untuk tekanan
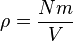 .
.
Maka tekanan adalah
 yakni suatu sifat mikroskopik. Ketahuilah bahwa hasil kali tekanan dan volume adalah sepertiga dari keseluruhan energi kinetik.
yakni suatu sifat mikroskopik. Ketahuilah bahwa hasil kali tekanan dan volume adalah sepertiga dari keseluruhan energi kinetik.
Derivat:

Suhunya menjadi
Dari persamaan 1 dan 3 didapat:
Karena 3N adalah derajat kebebasan (DK) dalam sebuah sistem gas monoatomik dengan N partikel, energi kinetik tiap DK adalah:
Assuming an ideal gas, a derivation[3] results in an equation for total number of collisions per unit time per area:
Other pioneers of the kinetic theory (which were neglected by their contemporaries) were Mikhail Lomonosov (1747),[4] Georges-Louis Le Sage (ca. 1780, published 1818),[5] John Herapath (1816)[6] and John James Waterston (1843),[7] which connected their research with the development of mechanical explanations of gravitation. In 1856 August Krönig (probably after reading a paper of Waterston) created a simple gas-kinetic model, which only considered the translational motion of the particles. [8]
In 1857 Rudolf Clausius, according to his own words independently of Krönig, developed a similar, but much more sophisticated version of the theory which included translational and contrary to Krönig also rotational and vibrational molecular motions. In this same work he introduced the concept of mean free path of a particle. [9] In 1859, after reading a paper by Clausius, James Clerk Maxwell formulated the Maxwell distribution of molecular velocities, which gave the proportion of molecules having a certain velocity in a specific range. This was the first-ever statistical law in physics.[10] In his 1873 thirteen page article 'Molecules', Maxwell states: “we are told that an 'atom' is a material point, invested and surrounded by 'potential forces' and that when 'flying molecules' strike against a solid body in constant succession it causes what is called pressure of air and other gases.”[11] In 1871, Ludwig Boltzmann generalized Maxwell's achievement and formulated the Maxwell–Boltzmann distribution. Also the logarithmic connection between entropy and probability was first stated by him.
In the beginning of twentieth century, however, atoms were considered by many physicists to be purely hypothetical constructs, rather than real objects. An important turning point was Albert Einstein's (1905)[12] and Marian Smoluchowski's (1906)[13] papers on Brownian motion, which succeeded in making certain accurate quantitative predictions based on the kinetic theory.
disebabkan oleh denyut-denyut statis di antara molekul-molekul, seperti yang diduga Isaac Newton, melainkan disebabkan oleh tumbukan antarmolekul yang bergerak pada kecepatan yang berbeda-beda. Teori Kinetik dikenal pula sebagai Teori Kinetik-Molekular atau Teori Tumbukan atau Teori Kinetik pada Gas.
Postulat
Teori untuk gas ideal memiliki asumsi-asumsi berikut ini:- Gas terdiri dari partikel-partikel sangat kecil, dengan [[massa] tidak nol.
- Banyaknya molekul sangatlah banyak, sehingga perlakuan statistika dapat diterapkan.
- Molekul-molekul ini bergerak secara konstan sekaligus acak. Partikel-partike yang bergerak sangat cepat itu secara konstan bertumbukan dengan dinding-dinding wadah.
- Tumbukan-tumbukan partikel gas terhadap dinding wadah bersifat lenting (elastis) sempurna.
- Interaksi antarmolekul dapat diabaikan (negligible). Mereka tidak mengeluarkan gaya satu sama lain, kecuali saat tumbukan terjadi.
- Keseluruhan volume molekul-molekul gas individual dapat diabaikan bila dibandingkan dengan volume wadah. Ini setara dengan menyatakan bahwa jarak rata-rata antarpartikel gas cukuplah besar bila dibandingkan dengan ukuran mereka.
- Molekul-molekul berbentuk bulat (bola) sempurna, dan bersifat lentur (elastic).
- Energi kinetik rata-rata partikel-partikel gas hanya bergantung kepada suhu sistem.
- Efek-efek relativistik dapat diabaikan.
- Efek-efek Mekanika kuantum dapat diabaikan. Artinya bahwa jarak antarpartikel lebih besar daripada panjang gelombang panas de Broglie dan molekul-molekul dapat diperlakukan sebagai objek klasik.
- Waktu selama terjadinya tumbukan molekul dengan dinding wadah dapat diabaikan karena berbanding lurus terhadap waktu selang antartumbukan.
- Persamaan-persamaan gerak molekul berbanding terbalik terhadap waktu.
Teori Kinetik juga telah diperluas untuk memasukkan tumbukan tidak lenting di dalam materi butiran oleh Jenkins dan kawan-kawan.[rujukan?]
[sunting] Faktor
[sunting] Tekanan
Tekanan dijelaskan oleh teori kinetik sebagai kemunculan dari gaya yang dihasilkan oleh molekul-molekul gas yang menabrak dinding wadah. Misalkan suatu gas denagn N molekul, masing-masing bermassa m, terisolasi di dalam wadah yang mirip kubus bervolume V. Ketika sebuah molekul gas menumbuk dinding wadah yang tegak lurus terhadap sumbu koordinat x dan memantul dengan arah berlawanan pada laju yang sama (suatu tumbukan lenting), maka momentum yang dilepaskan oleh partikel dan diraih oleh dinding adalah:Partikel memberi tumbukan kepada dinding sekali setiap 2l/vx satuan waktu (di mana l adalah panjang wadah). Kendati partikel menumbuk sebuah dinding sekali setiap 1l/vx satuan waktu, hanya perubahan momentum pada dinding yang dianggap, sehingga partikel menghasilkan perubahan momentum pada dinding tertentu sekali setiap 2l/vx satuan waktu.
Besaran kecepatan untuk tiap-tiap partikel mengikuti persamaan ini:
Misalkan ada sejumlah besar partikel yang bergerak cukup acak, gaay pada tiap-tiap dinding akan hampir sama dan kini perhatikanlah gaya pada satu dinding saja, kita punya:
 dapat dituliskan sebagai
dapat dituliskan sebagai 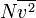 , di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan
, di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan  di mana vrms dalah akar kuadrat rata-rata kecepatan semua partikel.
di mana vrms dalah akar kuadrat rata-rata kecepatan semua partikel.Jadi, gaya dapat dituliskan sebagai:
Jadi, karena luas bagian yang berseberangan dikali dengan panjang sama dengan volume, kita punya pernyataan berikut untuk tekanan
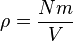 .
.Maka tekanan adalah
 yakni suatu sifat mikroskopik. Ketahuilah bahwa hasil kali tekanan dan volume adalah sepertiga dari keseluruhan energi kinetik.
yakni suatu sifat mikroskopik. Ketahuilah bahwa hasil kali tekanan dan volume adalah sepertiga dari keseluruhan energi kinetik.[sunting] Suhu dan energi kinetik
Dari hukum gas ideal-
- PV = NkBT(1)
Derivat:
-

 (2)
(2)

Suhunya menjadi
-
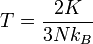 (3)
(3)
| “ | Rerata energi kinetik molekuler adalah sebanding dengan suhu absolut. | ” |
-
 (4)
(4)
Karena 3N adalah derajat kebebasan (DK) dalam sebuah sistem gas monoatomik dengan N partikel, energi kinetik tiap DK adalah:
-
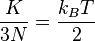 (5)
(5)
- Tiap mole: 12.47 J
- Tiap molekul: 20.7 yJ = 129 μeV
- Tiap mole: 3406 J
- Tiap molekul: 5.65 zJ = 35.2 meV
[sunting] Banyaknya tumbukan dengan dinding
Jumlah tumbukan atom dengan dinding wadah tiap satuan luar tiap satuan waktu dapat diketahui. Asumsikan pada gas ideal, derivasi dari [2] menghasilkan persamaan untuk jumlah seluruh tumbukan tiap satuan waktu tiap satuan luas:[sunting] Laju RMS molekul
Dari persamaan energi kinetik dapat ditunjukkan bahwa:[sunting] Banyaknya tumbukan dengan dinding
One can calculate the number of atomic or molecular collisions with a wall of a container per unit area per unit time.Assuming an ideal gas, a derivation[3] results in an equation for total number of collisions per unit time per area:
[sunting] Laju RMS molekul
From the kinetic energy formula it can be shown that[sunting] Sejarah
In 1738 Daniel Bernoulli published Hydrodynamica, which laid the basis for the kinetic theory of gases. In this work, Bernoulli positioned the argument, still used to this day, that gases consist of great numbers of molecules moving in all directions, that their impact on a surface causes the gas pressure that we feel, and that what we experience as heat is simply the kinetic energy of their motion. The theory was not immediately accepted, in part because conservation of energy had not yet been established, and it was not obvious to physicists how the collisions between molecules could be perfectly elastic.Other pioneers of the kinetic theory (which were neglected by their contemporaries) were Mikhail Lomonosov (1747),[4] Georges-Louis Le Sage (ca. 1780, published 1818),[5] John Herapath (1816)[6] and John James Waterston (1843),[7] which connected their research with the development of mechanical explanations of gravitation. In 1856 August Krönig (probably after reading a paper of Waterston) created a simple gas-kinetic model, which only considered the translational motion of the particles. [8]
In 1857 Rudolf Clausius, according to his own words independently of Krönig, developed a similar, but much more sophisticated version of the theory which included translational and contrary to Krönig also rotational and vibrational molecular motions. In this same work he introduced the concept of mean free path of a particle. [9] In 1859, after reading a paper by Clausius, James Clerk Maxwell formulated the Maxwell distribution of molecular velocities, which gave the proportion of molecules having a certain velocity in a specific range. This was the first-ever statistical law in physics.[10] In his 1873 thirteen page article 'Molecules', Maxwell states: “we are told that an 'atom' is a material point, invested and surrounded by 'potential forces' and that when 'flying molecules' strike against a solid body in constant succession it causes what is called pressure of air and other gases.”[11] In 1871, Ludwig Boltzmann generalized Maxwell's achievement and formulated the Maxwell–Boltzmann distribution. Also the logarithmic connection between entropy and probability was first stated by him.
In the beginning of twentieth century, however, atoms were considered by many physicists to be purely hypothetical constructs, rather than real objects. An important turning point was Albert Einstein's (1905)[12] and Marian Smoluchowski's (1906)[13] papers on Brownian motion, which succeeded in making certain accurate quantitative predictions based on the kinetic theory.
Langganan:
Posting Komentar (Atom)
Blogger news
About Me
- Kyki's Blog
Diberdayakan oleh Blogger.
Blogroll
Welcome To Kyki's Blog. I build this blog in order to share information or knowledge that I know. Hopefully this blog useful. Thanks
Popular Posts
-
Defenisi : Salah satu definisi menyebutkan bahwa statistik adalah metode ilmiah untuk menyusun, meringkas, menyajikan dan menganalis...
-
Reaksi kimia merupakan contoh yang paling sesuai untuk perubahan kimia. Pada reaksi kimia, satu zat atau lebih diubah menjadi zat baru. Zat...
-
SOAL-SOAL DEKLARASI 1. Manakah yang mendeklarasikan tipe enumerasi dengan tepat? a. Type a=integer; b. Type a=1..300; c. Type a=(baik, jelek...
-
Procedure, Narrative And Expressions Procedure How to make Lemonade Ingredients: For each glass use: - 2 tablespoons of lemon jui...
-
DEFINITION : Advertising is a form of communication intended to persuade an audience (viewers, readers or listeners) to purchase or take s...
-
DEPARTEMEN PENDIDIKAN NASIONAL DIRJEN MANAJEMEN PENDIDIKAN DASAR DAN MENENGAH DIREKTORAT PENDIDIKAN MENENGAH UMUM TEST SELEKSI TINGKAT PROVI...
-
ACTIVE AND PASSIVE VOICE Kalimat Aktif dan Kalimat Pasif Kata kerja transitif mempunyai dua voice (ragam gramatikal), aktif dan pas...
-
integral di 07:15 Integral adalah kebalikan dari proses diferensiasi. Integral ditemukan menyusul ditemukannya masalah dalam diferensiasi ...
-
LATIHAN SOAL 2009 (pelatihan OA 2009) LINGKARILAH JAWABAN YANG TEPAT 1. Matahari menjadi pusat Tata Surya karena a. Memancarkan cahaya b....
-
PERPANGKATAN DAN AKAR BILANGAN Perpangkatan Perpangkatan bilangan adalah perkalian berulang atau berganda bilangan dengan faktor-faktor...
Follow This Blog
Blogger templates
Tags
- Bahasa Arab Kelas XII (2)
- Bahasa Indonesia SMA X (3)
- Bahasa Indonesia SMA XI (3)
- Bahasa Indonesia SMA XII (3)
- Bahasa Inggris SMA X (3)
- Bahasa Inggris SMA XI (3)
- Bahasa Inggris SMA XII (3)
- Bahasa Jepang Kelas XII (3)
- Biologi Kelas XII (2)
- Biologi SMA X (3)
- Biologi SMA XI (3)
- Biologi SMA XII (3)
- Ekonomi SMA X (3)
- Fisika SMA X (3)
- Fisika SMA XI (3)
- Fisika SMA XII (3)
- Geografi SMA X (3)
- Kimia SMA X (3)
- Kimia SMA XI (3)
- Kimia SMA XII (3)
- Kitty Wedding (1)
- Matematika SMA X (3)
- Matematika SMA XI (3)
- Matematika SMA XII (3)
- OSN Astronomi (1)
- OSN Biologi (1)
- OSN Ekonomi (1)
- OSN Fisika (1)
- OSN Kebumian (1)
- OSN Kimia (1)
- OSN Matemika (1)
- OSN Tik (1)
- Pend. Agama Islam SMA X (3)
- Pend. Agama Islam SMA XI (3)
- Pend. Agama Islam SMA XII (3)
- Penjaskes SMA X (3)
- Penjaskes SMA XI (3)
- Penjaskes SMA XII (3)
- Pkn SMA X (3)
- Pkn SMA XI (3)
- Pkn SMA XII (3)
- Sejarah SMA X (3)
- Sejarah SMA XI (3)
- Sejarah SMA XII (3)
- Seni budaya kelas XII (2)
- Sosiologi SMA X (3)
- Terselubung (3)
- TIK SMA XI (2)
- TIK SMA XII (2)
- TIK SMA XIII (1)
Blog archive
-
▼
2012
(125)
-
▼
April
(32)
- Peristiwa Rengasdengklok
- Perjuangan Menghadapi Pergolakan Dalam Negeri
- Upaya Mengisi Kemerdekaan
- Panduan Membuat Blog di Blogspot
- Cara Custom Domain di Blogger
- Belajar Menghargai Orang Lain
- Dosa-Dosa Besar
- Perkembangan Islam Pada Masa Modern
- Active And Passive Voice
- Procedure, Narrative And Expressions
- Advertisement
- Mengenai Resensi Buku
- Pementasan Drama
- Teori dan Tekhnik Teater
- Sistem Hukum Dan Peradilan Nasional
- Budaya Demokrasi Menuju Masyarakat Madani
- Budaya Politik Indonesia
- Sistem Sirkulasi Manusia
- Sistem Ekskresi Pada Manusia
- Sistem Imun
- Reaksi Netralisasi
- Kesetimbangan Kimia
- Hidrolisis Garam
- Tehnik Lompat Jauh
- Tehnik Bermain Volly
- Teknik Lempar Cakram Yang Baik
- Kinematika Fisika
- Teori Kinetik Gas
- Hukum Boyle
- Statistik
- Suku Banyak
- Limit Fungsi
-
▼
April
(32)







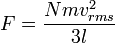

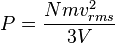


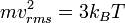



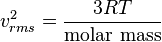
0 komentar:
Posting Komentar